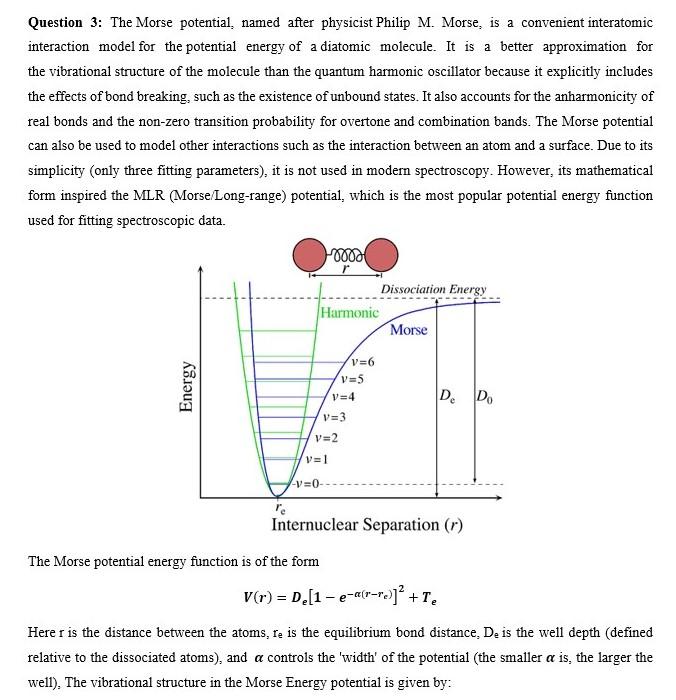
Das Morse-Potential ist ein Begriff aus der Molekülphysik. Der 1929 vom US-amerikanischen Physiker Philip McCord Morse vorgeschlagene Zusammenhang beschreibt den Verlauf des elektronischen Potentials eines zweiatomigen Moleküls in Abhängigkeit vom Kernbindungsabstand durch eine exponentielle Näherung:
mit
- die (spektroskopische) Dissoziationsenergie
- der Kernabstand mit der geringsten potentiellen Energie und
- eine Konstante (manchmal als „Steifigkeit des Potentials“ bezeichnet)
Diese Größen sind für das betrachtete Molekül charakteristisch.
Da man üblicherweise das Potential im Unendlichen als null definiert:
wird das Morse-Potential häufig in der alternativen Form angegeben:
Dadurch verschiebt sich das Nullpunktpotential um . Diese Verschiebung ermöglicht die Definition eines cutoff-Radiuses, ab dem das Potential nicht mehr berücksichtigt wird.
Die Schrödinger-Gleichung ist mit dem Morsepotential analytisch lösbar. So können die Schwingungsenergien berechnet werden:
mit
- dem planckschen Wirkungsquantum
- der Schwingungsquantenzahl
- der Frequenz , die über die Teilchenmasse mit der Konstante des Morse-Potentials verknüpft ist
Heutzutage wird für die Berechnung von Schwingungsenergien eher das RKR-Potential (RKR steht hierbei für Ragnar Rydberg, Oskar Klein und Lloyd Rees) oder das Lennard-Jones-Potential angewendet.
Literatur
- Wolfgang Demtröder: Molekülphysik: Theoretische Grundlagen und experimentelle Methoden. Oldenbourg Wissenschaftsverlag, 2003, ISBN 978-3-486-24974-3, S. 93–94.
- Ludwig Bergmann, Clemens Schaefer, Wilhelm Raith, Mit Beitragen Von H. Kleinpoppen, M. Fink, N. Risch: Bestandteile der Materie: Atome, Moleküle, Atomkerne, Elementarteilchen. Walter de Gruyter, 2003, ISBN 978-3-11-016800-6, S. 460–462.
- Gerd Otter, Raimund Honecker: Atome – Moleküle – Kerne: Molekül- und Kernphysik. Vieweg Teubner, 1996, ISBN 978-3-519-03220-5, S. 152–154.
Einzelnachweise